Lieferengpässe, Lösungsansätze, Diskussionen
„Fiebersaft ausverkauft“ – manch eine Apotheke in Deutschland hatte solch ein Schild im Dezember 2022 an der Tür hängen. Eltern kranker Kinder klapperten auf der Suche nach fiebersenkenden Mitteln teilweise zehn Apotheken und mehr ab, oft vergeblich. Die Situation war dramatisch, doch neu war sie nicht.
Nicht zum ersten Mal sorgten im Winter 2022 Probleme mit der Arzneimittelversorgung für Schlagzeilen. Im Frühling 2022 war es eine Versorgungslücke beim Brustkrebsmedikament Tamoxifen, die für Verunsicherung sorgte. 2019 mangelte es mit Propofol an einem wichtigen Medikament der Intensivmedizin. 2018 fehlte der Blutdrucksenker Valsartan, 2017 das Breitband-Antibiotikum Tazobactam, 2016 das Schmerzmittel Metamizol und in den Jahren davor die Zytostatika Melphalan und Doxorubicin. Auch Grippeimpfstoffe waren bereits von Lieferengpässen betroffen. Daher hat schon 2012 der Vorsitzende der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) Prof. Dr. med. Wolf-Dieter Ludwig politische Maßnahmen gefordert.
Lauterbachs Eckpunktepapier zur Vermeidung von Lieferengpässen
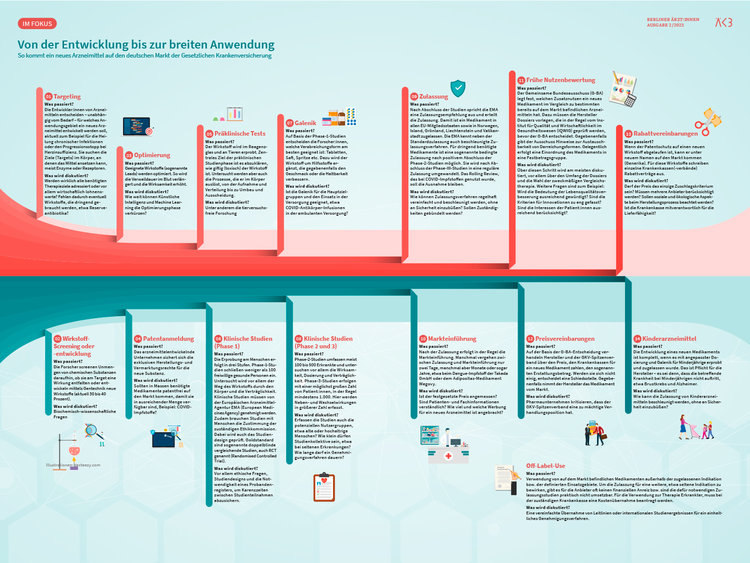
Lange Zeit passierte wenig, um den wiederkehrenden Engpässen entgegenzuwirken. Aus einem Runden Tisch mit den Herstellerverbänden wurde ein Jour fixe, der 2020 in einen dauerhaften Beirat für Arzneimittel-Lieferengpässe beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) überging. Dorthin melden Pharmaunternehmen nun Lieferschwierigkeiten. Behoben hat das die Engpässe jedoch nicht. Gleichzeitig wurden über Jahre hinweg Instrumente zur Begrenzung der Arzneimittelausgaben der Gesetzlichen Krankenversicherung (GKV) entwickelt. Zu den wirkungsvollsten zählen die Frühe Nutzenbewertung für neue Arzneimittel (seit 2011), das Preismoratorium (2010), Rabattverträge (2003) und Festbeträge (1989). Hersteller beklagten von Anfang an, dass diese Instrumente einen immensen Kostendruck auf die Arzneimittelproduktion erzeugten.
„Wir haben es mit der Ökonomisierung auch in der Arzneimittelversorgung mit patentfreien Medikamenten übertrieben“, stellte auch Bundesgesundheitsminister Prof. Dr. med. Karl Lauterbach (SPD) am 20. Dezember 2022 öffentlich fest. Es sei inakzeptabel, dass man in Deutschland für sein Kind nur schwer einen Fiebersaft bekomme, der im Ausland noch erhältlich sei, so der Minister. „Deswegen werden wir die Preisgestaltung von Kinderarzneien radikal ändern.“ Lauterbachs Eckpunkte zur „Vermeidung von Lieferengpässen von Arzneimitteln, Verbesserung der Versorgung mit Kinderarzneimitteln und Stärkung des Produktionsstandorts EU“ erfuhren jedoch ein geteiltes Echo. Während der GKV-Spitzenverband das angekündigte Maßnahmenpaket als „beeindruckendes Weihnachtsgeschenk“ an die Pharmaindustrie bezeichnete, kritisierten die Pharmaverbände, die Probleme seien zwar erkannt, aber nicht gelöst.
Arzneimittelversorgung im Krankenhaus – ein Rundgang
Das ALBVVG soll es richten
Seit Mitte Februar 2023 liegt das Maßnahmenpaket nun auch in Paragrafenform vor. Und damit hängt ein Preisschild an dem vermeintlichen Weihnachtsgeschenk. Der Referentenentwurf aus dem Bundesgesundheitsministerium (BMG) für ein „Gesetz zur Bekämpfung von Lieferengpässen bei patentfreien Arzneimitteln und zur Verbesserung der Versorgung mit Kinderarzneimitteln (Arzneimittel-Lieferengpassbekämpfungs- und Versorgungsverbesserungsgesetz – ALBVVG)“ veranschlagt mindestens eine halbe Milliarde Euro für dessen Umsetzung. Der Entwurf geht die Engpässe aus verschiedenen Richtungen an. Zu den Maßnahmen zählen im Einzelnen:
- eine Pflicht der Hersteller zur mehrmonatigen Lagerhaltung für Rabattarzneimittel
- vereinfachte Austauschregelungen für Arzneimittel mit kritischer Versorgungslage
- erhöhte Bevorratungsverpflichtungen für krankenhausversorgende Apotheken und Krankenhausapotheken bei Arzneimitteln zur parenteralen Anwendung in der intensivmedizinischen Versorgung und Antibiotika
- Der Ausbau des Beirats beim BfArM in ein Frühwarnsystem zur Erkennung drohender versorgungsrelevanter Lieferengpässe. Dazu erhält er zusätzliche Informationsrechte gegenüber Industrie und Großhändlern.
- Neue Preisregeln für anerkannte Reserveantibiotika mit neuen Wirkstoffen: Hersteller können den gewählten Abgabepreis über den sonst üblichen Zeitraum von sechs Monaten hinaus beibehalten
Lockerungen bei der Kostendämpfung
Die weitreichendsten und komplexesten Änderungen sind jedoch im Bereich der Kinderarzneimittel und Generika geplant. So sollen Arzneimittel für Kinder künftig keinen Festbetragsgruppen mehr zugeordnet werden. Für den Verkaufspreis soll stattdessen eine Preisobergrenze gelten, die 50 Prozent über dem bisherigen Festbetrag liegt. Welche Arzneimittel unter diese Regelung fallen, soll dem Referentenentwurf zufolge das BfArM nach Anhörung des Beirats für Lieferengpässe festlegen. Zudem soll das BMG ermächtigt werden, auf Empfehlung des BfArM und nach Anhörung des GKV-Spitzenverbands die Anhebung von Festbeträgen für versorgungskritische Arzneimittel anzuordnen.
Bei Generika sollen die Grenzen für die Zuzahlungsbefreiung angehoben werden. Bislang gilt, dass sie nur dann ohne Zuzahlung zur Rezeptgebühr abgegeben werden, wenn ihr Preis 30 Prozent unter dem Festbetrag liegt. Diese Marge wird auf 20 Prozent gesenkt. Wenn sich der Markt für bestimmte Arzneimittel auf wenige Anbieter konzentriert, soll die Festbetragsgruppe ganz aufgehoben werden können. Zudem müssen Krankenkassen beim Abschluss von Rabattverträgen über Onkologika oder Antibiotika künftig mindestens zur Hälfte Hersteller mit Produktion in Europa berücksichtigen.
Interessant sind jedoch auch die erweiterten Informationsrechte und Befugnisse des BfArM. Während die Mitteilungspflichten der Arzneimittelhersteller über Lieferschwierigkeiten bislang weitgehend ungeregelt sind, sollen sie künftig erweitert und mit einem Bußgeld verknüpft werden. „Dies ist erforderlich, um die zur Beurteilung der Versorgungslage notwendigen Informationen vollumfänglich zu erhalten. In der Vergangenheit kam es teilweise zu verzögerten und unvollständigen Meldungen; in Einzelfällen unterblieben Meldungen vollständig“, heißt es dazu in dem Referentenentwurf. Unter anderem sollen die Hersteller etwa auch die Bezugsquelle der verwendeten Wirkstoffe mitteilen müssen. „Diese Informationen sind wichtig, um drohende Engpässe zu erkennen, wenn beispielsweise eine Wirkstoffherstellungsstätte von verschiedenen pharmazeutischen Unternehmen und Herstellern genutzt wird“, so der Referentenentwurf.
Die Erhöhung von Festbetragsgrenzen und Preisen wird die globalen Probleme mit Lieferengpässen nicht lösen.
Das sagen Pharma-, Apotheken- und Kassenverbände
Das BfArM begrüßt „jeden weiteren Ausbau des gesetzlichen Handlungsrahmens, der auf eine weitere Stärkung des BfArM und damit auf eine schnelle und erfolgreiche Abmilderung von absehbaren oder bestehenden Lieferengpässen abzielt“, so ein Sprecher auf Nachfrage. Das Institut vertritt zwar die Auffassung, dass das Management von Lieferengpässen in den vergangenen Jahren bereits deutlich verbessert wurde. So seien sich abzeichnende Versorgungslücken schneller erkannt, transparenter kommuniziert und in vielen Fällen ganz vermieden oder schnell wirkungsvolle Gegenmaßnahmen angestoßen worden. Doch: „Unabhängig von einzelnen aktuellen Lieferengpass-Meldungen fordert das BfArM schon seit Längerem mehr Transparenz von der Pharmaindustrie“, so der Sprecher weiter.
Der AOK-Bundesverband indes übt grundsätzliche Kritik am Zuschnitt des Beirats beim BfArM. Er fordert, dass dort künftig auch Vertreter:innen der Krankenkassen eine angemessene Stimme erhalten. Außerdem soll mehr staatliche Kontrolle bei der Arzneimittelaufsicht liegen und die europäische Zusammenarbeit verstärkt werden. Vor allem aber widerspricht der Kassenverband Lauterbachs Diagnose, die Situation sei durch die übertriebene Ökonomisierung in Deutschland verursacht. Engpässe seien vielmehr ein globales Problem. „Die Erhöhung von Festbetragsgrenzen und Preisen wird die globalen Probleme mit Lieferengpässen nicht lösen“, meint daher die Chefin des Verbandes Dr. Carola Reimann.
Immer auf dem Laufenden bleiben. Melden Sie sich hier für unseren Newsletter an.
Pharma-Verbände kritisieren Begrenzung der Maßnahmen
Die Verbände der Arzneimittelhersteller begrüßen den Gesetzentwurf im Allgemeinen, sehen darin jedoch zumeist nur einen Anfang. „Warum setzt man nur in einzelnen Bereichen an, wo die Probleme doch die gesamte Grundversorgung betreffen?“, fragt etwa der Vorsitzende des Bundesverbandes der Pharmazeutischen Industrie (BPI), Dr. Hans-Georg Feldmeier. Und der Präsident des Verbandes Forschender Arzneimittelhersteller (vfa), Han Steutel bewertet den Referentenentwurf als „Stückwerk“. Sein Verband fordert in einem 5-Punkte-Plan unter anderem regelmäßige Stresstests für Lieferketten.
Der Verband Pro Generika kritisiert ebenfalls, dass der Referentenentwurf bestimmte Maßnahmen auf Antibiotika und Krebsmittel begrenzt. Diese machen laut Pro Generika gerade einmal 1,1 Prozent aller Arzneimittel in Tagestherapiedosen aus. „Wie erklärt die Politik einer Diabetespatientin, dass ihre Versorgung weniger verlässlich sein muss als die eines anderen?“, fragt Pro Generika Geschäftsführer Bork Bretthauer und fordert, dass die Maßnahmen für alle Generika gelten sollten. Der Verband weist darauf hin, dass der anhaltende Kostendruck aktuell durch die Inflation verstärkt werde und warnt davor, dass sich noch mehr Hersteller aus der Produktion zurückziehen könnten.
Die ABDA Bundesvereinigung Deutscher Apothekenverbände kritisiert, die Apotheker:innen würden allein gelassen. Der Gesetzentwurf sieht vor, dass ihr Aufwand bei Lieferengpässen mit einem Zuschlag von 50 Cent für jeden Vorgang vergütet wird, bei dem ein Arzneimittel betroffen ist, für das das BfArM einen Lieferengpass festgestellt hat. Zu wenig, findet die ABDA, und fordert 21 Euro pro Austauschvorgang.
Und was sagen die Ärztinnen und Ärzte zum Reformvorschlag?
Indes fordert die Kassenärztliche Bundesvereinigung (KBV), dass die Apotheker:innen verpflichtet werden, die verordnenden Ärzt:innen über jeden Austausch zu informieren. Das ist im Entwurf bisher nicht vorgesehen. Zudem weist die KBV in ihrer Stellungnahme zum Gesetzentwurf darauf hin, dass Lieferengpässe auch bei den Ärzt:innen Aufwände verursachen, für die bisher keine Vergütung vorgesehen sei.
Außerdem müsse gewährleistet sein, dass den Ärzt:innen keine Regressrisiken aus den Preissteigerungen bei bestimmten Arzneimitteln entstehen. Lieferengpässe und Austauschvorgänge können nach Auffassung der KBV zudem dazu führen, dass Niedergelassene die Versorgungs- und Wirtschaftlichkeitsziele nicht erreichen können, die Krankenkassen und Kassenärztliche Vereinigungen jährlich in der Arzneimittelvereinbarung festlegen. Auch hier fordert die KBV eine gesetzliche Klarstellung, dass die neuen Regelungen nicht zulasten der Arzneimittelbudgets der ambulant tätigen Ärzt:innen gehen.
Probleme auch jenseits der Lieferengpässe
Die Bundesärztekammer (BÄK) und die AkdÄ warnen in ihrer Stellungnahme, dass das Frühwarnsystem mit seinen Meldepflichten zu weiterer Bürokratie führen könne und fragen, wie das BfArM zur Errichtung eines Frühwarnsystems qualifiziert sei oder noch zu qualifizieren sei. Die Maßnahmen zur Diversifizierung von Lieferketten über das GKV-Vergaberecht greifen nach Einschätzung von BÄK und AkdÄ zu kurz. Der Gesetzgeber gehe dabei davon aus, dass es genug Hersteller mit Produktionsstandorten innerhalb Europas gibt. Viele Grundstoffe von Arzneimitteln würden jedoch mittlerweile ausschließlich außerhalb Europas produziert.
BÄK-Präsident Dr. med. Klaus Reinhardt hatte Anfang Februar zusätzlich Anreize für die Einführung neuer Reserveantibiotika gefordert und zugleich für ein striktes, EU-weites Verbot des Einsatzes von humanmedizinischen Reserveantibiotika in der Tierhaltung plädiert. Probleme bei der Arzneimittelversorgung in Deutschland sieht Reinhardt jedoch nicht nur aufgrund der zunehmenden Lieferengpässe. Der BÄK-Präsident kritisiert auch, dass es bei der Anmeldung von Studien bei der europäischen Arzneimittelbehörde EMA nach wie vor zu Problemen komme. Vor einem Jahr wurde dafür das sogenannte Clinical Trials Information System (CTIS) eingeführt. Doch das läuft nach Reinhardts Angaben auch nach Ablauf der Übergangsphase alles andere als rund. „Diese digitale Plattform ist technisch nicht ausgereift, was dazu führt, dass viele der Anträge nicht eingereicht werden können“, so Reinhardt. Die BÄK habe Sorge, dass das zu Verzögerungen mit der Folge verspäteter Einführung von Innovationen führen könne. Doch das ist eine andere Geschichte.